앞으로 의료기기 업체는 의료기기 허가와 신의료기술평가를 한 번에 신청하고 동시에 심의를 받은 후 바로 시장에 진입할 수 있게 된다.
이는 제4차 규제개혁장관회의(’15.11.6)시 발표한 ‘신의료기술평가 간소화․신속화’의 후속조치로 업체가 식약처에 한 번만 신청하면 심의 과정에서 복지부와 식약처가 검토내용을 내부 조율하고 조율된 결과가 반영된 통합 허가증만 받으면 시장진입이 가능해진다.
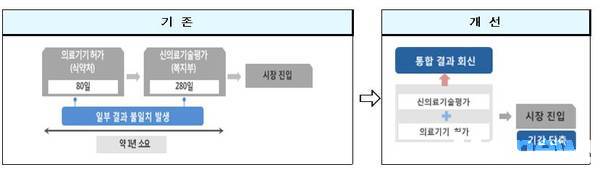
지금까지 의료기기의 시장 진입을 위해서는 식약처 의료기기 허가 후 신의료기술평가를 순차적으로 거쳐야 해 총 1년이 걸렸다.
오는 7월 전면 시행을 앞두고 오는 22일부터 실시되는 시범사업의 주요내용은 적용대상, 허가․평가절차, 허가․평가기간 등이다.
① 적용 대상 - 시장 진입을 위해 허가와 신의료기술평가가 모두 필요한 의료기기로 ▴의료기기와 의료기기를 이용한 의료기술의 사용목적이 동일하고, ▴허가 시 사람을 대상으로 하는 임상시험이 필요한 의료기기이다.
이 사업은 의료기기 제조․수입업체의 신청에 따라 적용되기 때문에 업체가 국내 판매 계획은 없고, 해외 수출 또는 개발도상국 기부 등을 위해 의료기기 허가를 원하는 경우에는 통합운영 시범사업 신청 없이 식약처의 의료기기 허가만을 신청할 수 있다.
② 허가․평가절차- 업체가 식약처에 통합 신청서를 제출하면 의료기기 허가와 복지부의 신의료기술평가가 동시에 시작되는 것으로 복지부(보건의료연구원)는 식약처에 의료기술에 대한 자료를 제공하고 식약처는 신의료기술평가위원회에 참석하여 의료기기에 대해 설명하는 등 상호 의견 교환을 통해 검토내용을 조율한다.
기존에는 허가 후에 신의료기술평가가 순차적으로 실시되었고, 복지부와 식약처에서 별도로 신청․검토․회신이 이루어졌다.
③허가․평가기간- 통합운영에는 시장진입까지 총 80~140일이 걸려, 기존 절차에 따라 소요되는 기간(총 1년)에 비해 최대 9개월이 단축된다. 다만, 일부 시술 등 검토기간의 연장이 필요한 경우 최장 280일 소요된다.
복지부와 식약처는 이외에 추가 제도개선을 통해 신의료기술평가의 간소화, 현장과의 소통 강화를 추진할 계획인데 상반기 중에는 안전성 우려가 낮은 검사분야(체외진단, 유전자검사)는 핵심 원리가 동일한 경우 평가대상에서 제외하여, 식약처 허가 후 바로 시장진입이 가능한 대상을 2배 확대(30→60%)할 계획이다.
현재는 기존과 유사한 검사법도 방법이 일부 달라지면 신의료기술평가를 받아야 했으나, 향후 핵심원리가 동일한 경우 평가대상에서 제외된다.
복지부와 식약처 관계자는 “통합운영 시범사업을 신청한 경우에는 시장진입 기간 단축, 신청 및 회신이 편리해지는 효과가 있다”며 “7월까지 진행되는 시범사업 동안 최대한 많은 업체가 신청하여 혜택을 받으시기를 바란다”고 밝혔다.















